Chuyên đề phân biệt các hóa chất là dạng bài bác tập rất gần gũi thường chạm chán trong chương trình Hóa lớp 9, lớp 11 tuyệt 12. Để giải những dạng bài tập nhận thấy các chất hóa học, yêu cầu học sinh cần nỗ lực chắc loài kiến thức cũng như các cách thức giải. Nội dung bài viết dưới trên đây của DINHNGHIA.VN sẽ giúp đỡ bạn tổng hợp các kiến thức về công ty đề phân biệt các chất hóa học, cùng tò mò nhé!.
Chuyên đề nhận biết các chất hóa học lớp 9Phương pháp phân biệt các hóa học vô cơ
Phương pháp nhận biết các hóa chất hữu cơ lớp 11Bảng nhận thấy các chất hóa học lớp 8
Chuyên đề nhận ra các hóa chất lớp 9
Nguyên tắc với yêu cầu khi giải bài bác tập nhấn biết
Để rành mạch hay nhận thấy các hóa học hóa học, ta cần phụ thuộc phản ứng đặc trưng và xem xét những hiện tượng: Như gồm chất kết tủa chế tạo thành sau phản ứng, câu hỏi đổi màu dung dịch, giải tỏa chất bám mùi hoặc có hiện tượng lạ sủi bong bóng khí. Hoặc để phân biệt các chất hóa học, bạn có thể sử dụng một vài tính chất vật lí (nếu như bài xích cho phép) như nung ở nhiệt độ khác nhau, tốt hoà tan các chất vào nước…Phản ứng hoá học tập được chọn để nhận thấy là bội phản ứng đặc trưng dễ dàng và đơn giản và có tín hiệu rõ rệt. Trừ ngôi trường hợp sệt biệt, thường thì muốn phân biệt n hoá chất nên phải triển khai (n – 1) thí nghiệm.Tất cả các chất được lựa chọn dùng để nhận biết các hoá chất theo yêu cầu của đề bài, phần đa được xem là thuốc thử.Bạn đang xem: Phương pháp nhận biết các chất hóa học lớp 9
***Lưu ý: Khái niệm phân biệt bao gồm ý so sánh (ít nhất phải tất cả hai hoá chất trở lên) nhưng mục đích sau cuối của phân minh cũng là nhằm nhận biết thương hiệu của một số trong những hoá chất nào đó.Phương pháp giải bài xích tập phân biệt các hóa học hóa học
Bước 1: Đầu tiên phải chiết (trích mẫu mã thử) các chất cần nhận biết vào các ống nghiệm (có tấn công số ráng thể).Bước 2: chọn thuốc thử tương thích (tuỳ theo yêu cầu đề bài: thuốc demo tuỳ chọn, hạn chế hay là không dùng dung dịch thử làm sao khác).Bước 3: mang đến vào các ống nghiệm ghi nhận các hiện tượng, tiếp đến rút ra kết luận đã nhận được biết, rành mạch được hoá chất nào.Bước 4: Viết PTHH minh hoạ.
Các dạng bài xích tập hay gặp
Dạng 1: phân biệt hoặc phân biệt các hoá chất (rắn, lỏng, khí) riêng rẽ biệt.Dạng 2: nhận thấy hoặc phân biệt các chất trong cùng một hỗn hợp.Dạng 3: khẳng định việc xuất hiện của các chất (hoặc những ion) trong và một dung dịch.Tuỳ theo yêu cầu của bài bác tập mà trong mỗi dạng gồm thể gặp 1 trong các trường thích hợp sau:
Nhận biết với thuốc thử tự do (tùy chọn).Nhận biết với dung dịch thử hạn chế (có giới hạn).Nhận biết không được dùng thuốc thử mặt ngoài.Phương pháp nhận thấy các chất vô cơ
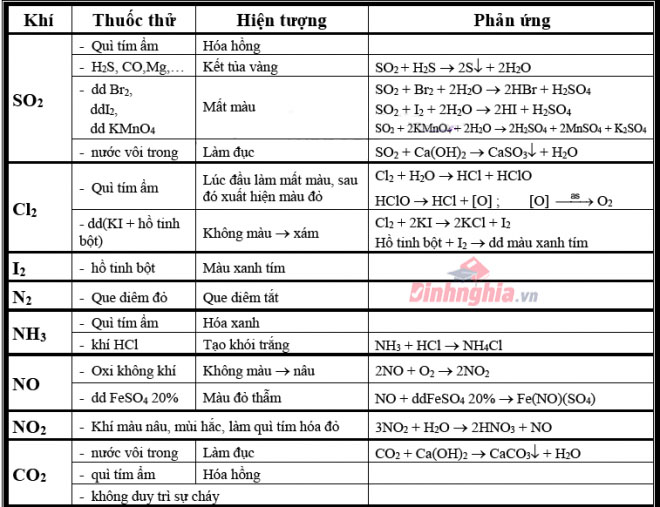
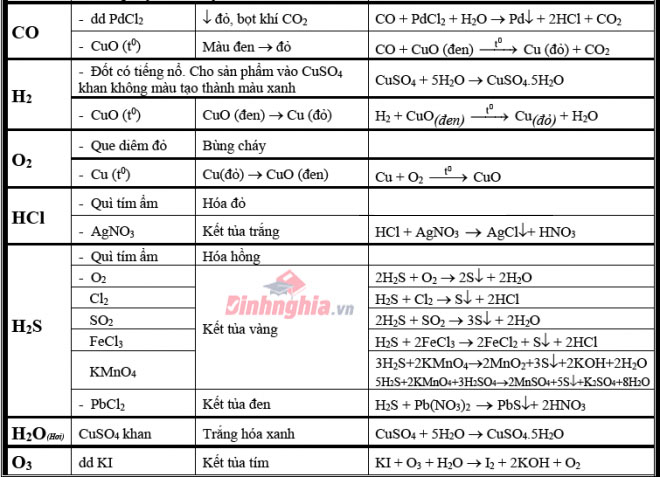
Đối với chất khí
Khí (CO_2): thực hiện dung dịch nước vôi trong có dư, hiện nay tượng xẩy ra là có tác dụng đục nước vôi trong.Khí (SO_2): nặng mùi hắc khó ngửi, làm phai màu huê hồng hoặc làm mất màu dung dịch nước Brôm hoặc làm mất màu hỗn hợp thuốc tím.(5SO_2 + 2KMnO_4 + 2H_2O ightarrow 2H_2SO_4 + 2Mn
SO_4 + K_2SO_4)Khí (NH_3): bám mùi khai, khiến cho quỳ tím tẩm ướt hóa xanh.Khí Clo: thực hiện dung dịch KI + hồ tinh bột để thử clo làm dung dịch từ white color chuyển thành color xanh.(Cl_2 + KI ightarrow 2KCl + I_2)Khí (H_2S): có mùi trứng thối, dùng dung dịch (Pb(NO_3)_2) để tạo thành Pb
S kết tủa color đen.Khí HCl: làm cho giấy quỳ tẩm ướt hoá đỏ hoặc sục vào hỗn hợp (Ag
NO_3) chế tác thành kết tủa màu trắng của Ag
Cl.Khí (N_2): Đưa que diêm đỏ vào làm que diêm tắt.Khí NO (không màu): Để ngoại trừ không khí hoá màu nâu đỏ.Khí (NO_2) (màu nâu đỏ): mùi hắc, có tác dụng quỳ tím tẩm ướt hoá đỏ.(4NO_2 + 2H_2O + O_2 ightarrow 4HNO_3)
Nhận biết dung dịch bởi quỳ tím
Để cần sử dụng quỳ tím nhận thấy các chất, ta cần lưu ý như sau:
Nhận biết hỗn hợp bazơ (kiềm): có tác dụng quỳ tím hoá xanhNhận biết hỗn hợp axit: có tác dụng quỳ tím hoá đỏ
Nhận biết hỗn hợp bazơ
Nhận biết (Ca(OH)_2):Dùng (CO_2) sục vào đến khi mở ra kết tủa thì ngừng lại.Dùng (Na_2CO_3) để chế tạo ra thành kết tủa white color của (CaCO_3)Nhận biết (Ba(OH)_2):Dùng dung dịch (H_2SO_4) để sinh sản thành kết tủa white color của (Ba_2SO_4)
Nhận biết dung dịch axit
Dung dịch HCl: dùng dung dịch (AgNO_3) làm lộ diện kết tủa white color của Ag
Cl.Dung dịch (H_2SO_4): cần sử dụng dung dịch (Ba
Cl_2) hoặc (Ba(OH)_2) tạo nên kết tủa (Ba
SO_4).Dung dịch (HNO_3): cần sử dụng bột đồng đỏ và đun ở ánh nắng mặt trời cao làm lộ diện dung dịch greed color và bao gồm khí màu nâu thoát ra của (NO_2).Dung dịch (H_2S): dùng dung dịch (Pb(NO_3)_2) xuất hiện thêm kết tủa màu black của Pb
S.Dung dịch (H_3PO_4): cần sử dụng dung dịch (Ag
NO_3) làm xuất hiện thêm kết tủa màu xoàn của (Ag_3PO_4).
Nhận biết các dung dịch muối
Muối clorua: sử dụng dung dịch (AgNO_3).Muối sunfat: áp dụng dung dịch (Ba
Cl_2) hoặc (Ba(OH)_2).Muối cacbonat: áp dụng dung dịch HCl hoặc (H_2SO_4).Muối sunfua: thực hiện dung dịch (Pb(NO_3)_2).Muối phôtphat: sử dụng dung dịch (Ag
NO_3) hoặc dùng dung dịch (Ca
Cl_2), (Ca(OH)_2) làm xuất hiện kết tủa mùa trắng của (Ca_3(PO_4)_2).
Nhận biết các oxit của kim loại
Hỗn phù hợp oxit: Hoà tan từng oxit vào nước (Bao bao gồm 2 nhóm: rã trong nước với không rã trong nước).
Nhóm rã trong nước cho tính năng với (CO_2)Nếu không có kết tủa: sắt kẽm kim loại trong oxit là sắt kẽm kim loại kiềm.Nhóm không tan nội địa cho công dụng với hỗn hợp bazơ.Nếu oxit rã trong dung dịch kiềm thì kim loại trong oxit là Be, Al, Zn, Cr..Nếu oxit ko tan trong hỗn hợp kiềm thì kim loại trong oxit là sắt kẽm kim loại kiềm thổ.Nhận biết một trong những oxit
((Na_2O; K_2O; BaO)) cho tính năng với nước ( ightarrow) dd vào suốt, có tác dụng xanh quỳ tím.((Zn
O; Al_2O_3)) vừa chức năng với dung dịch axit, vừa công dụng với dung dịch bazơ.Cu
O tan trong dung dịch axit tạo thành hỗn hợp có greed color đặc trưng.(P_2O_5) cho tác dụng với nước( ightarrow) dung dịch làm cho quỳ tím hoá đỏ.(Mn
O_2) cho chức năng với hỗn hợp HCl đặc có khí màu đá quý xuất hiện.
Nhận biết các chất kết tủa
Màu của một vài kết tủa hay gặp
(Al(OH)_3): kết tủa keo dán trắng.FeS: kết tủa màu sắc đen.(Fe(OH)_2): kết tủa white xanh.(Fe(OH)_3): kết tủa nâu đỏ.(Fe
Cl_2): dung dịch lục nhạt.(Fe
Cl_3): dung dịch vàng nâu.Cu: kết tủa là màu đỏ.(Cu(NO_3)_2): dung dịch xanh lam.(Cu
Cl_2): tinh thể có màu nâu, hỗn hợp xanh lá cây.(Fe_3O_4) (rắn): gray clolor đen.(Cu
SO_4): tinh thể khan color trắng, tinh thể ngậm nước màu xanh lam, hỗn hợp xanh lam.(Cu_2O): đỏ gạch.(Cu(OH)_2): kết tủa xanh rớt (xanh domain authority trời).Cu
O: kết tủa màu đen.(Zn(OH)_2): kết tủa keo dán giấy trắng.(Ag_3PO_4): kết tủa vàng.Ag
Cl: kết tủa màu sắc trắng.Ag
Br: kết tủa tiến thưởng nhạt.
Xem thêm: Thảm Trải Sàn Giá Thảm Trải Sàn Phòng Khách, Thảm Trải Sàn Giá Tốt Tháng 4, 2023
AgI: kết tủa kim cương cam (hay rubi đậm).(Ag_2SO_4): kết tủa trắng.(Mg
CO_3): kết tủa trắng.(Cu
S, Fe
S, Ag_2S, Pb
S, Hg
S): color đen.(Ba
SO_4): kết tủa trắng.(Ba
CO_3): kết tủa trắng.(Ca
SO_3): kết tủa trắng.(Mg(OH)_2): kết tủa màu sắc trắng.(Pb
I_2): kết tủa tiến thưởng tươi.
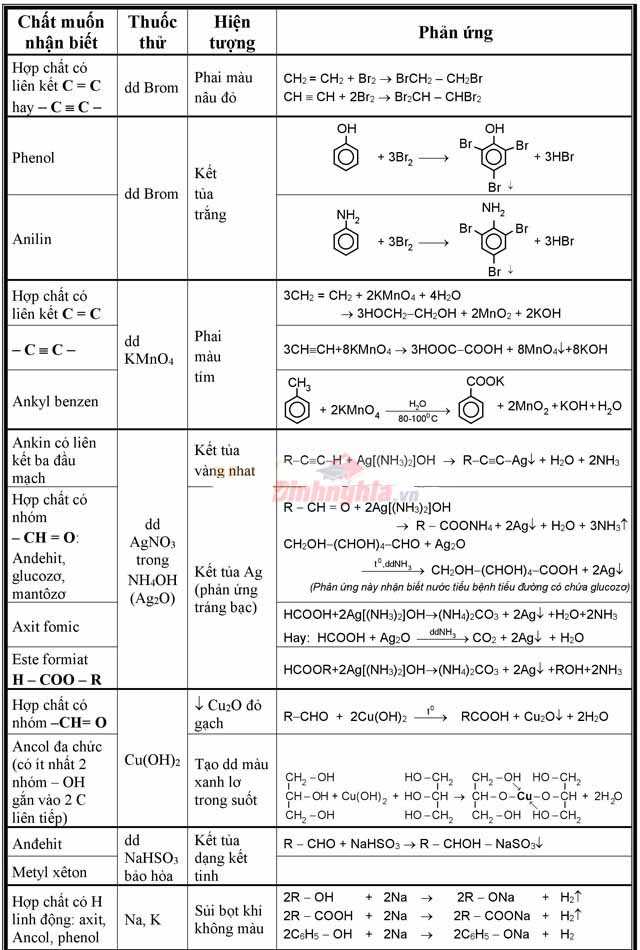
Phương pháp nhận thấy các hóa chất hữu cơ lớp 11
Với đề thi THPT giang sơn môn Hóa, dạng bài xích tập nhận ra các chất là dạng bài bác thường gặp gỡ và dễ lấy điểm. Mỗi một số loại chất sẽ sở hữu được những thuốc thử thường dùng khác nhau để phân biệt. Dưới đấy là bảng nhận biết các chất hữu cơ tổng kết những thuốc thử thường dùng cũng tương tự hiện tượng chiếm được khi nhận biết các hợp hóa học hữu cơ thường xuyên gặp.
Bảng nhận thấy các hóa học hữu cơ tổng quát
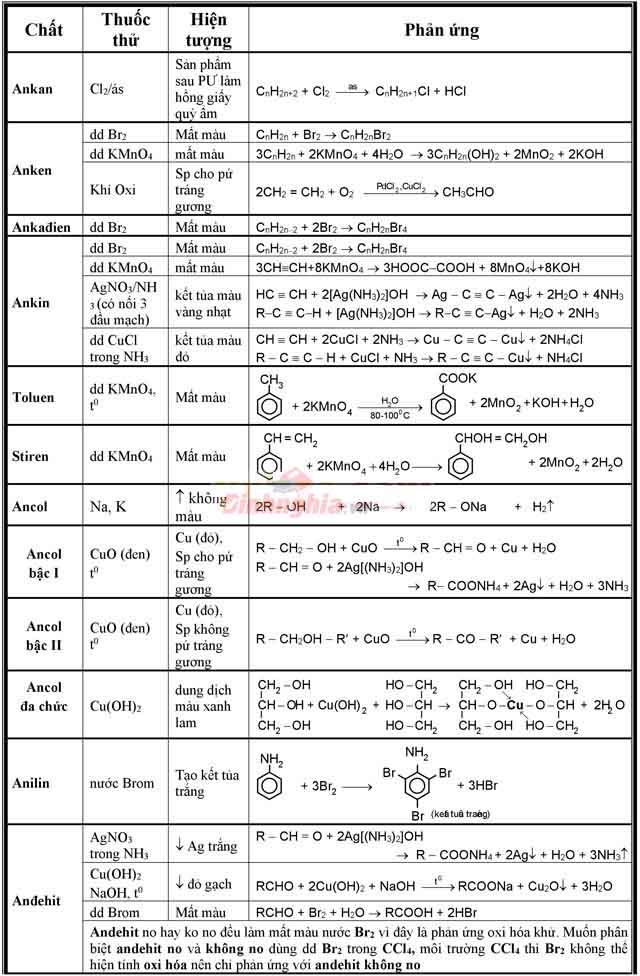
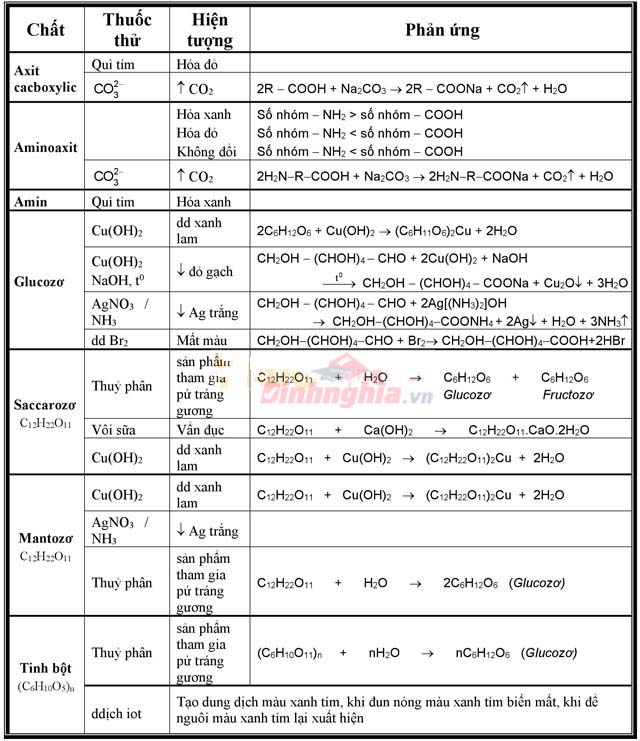
Bảng phân biệt các hóa học hữu cơ đưa ra tiết
Bảng nhận ra các hóa chất lớp 8
Trạng thái, màu sắc các đơn chất, phù hợp chất
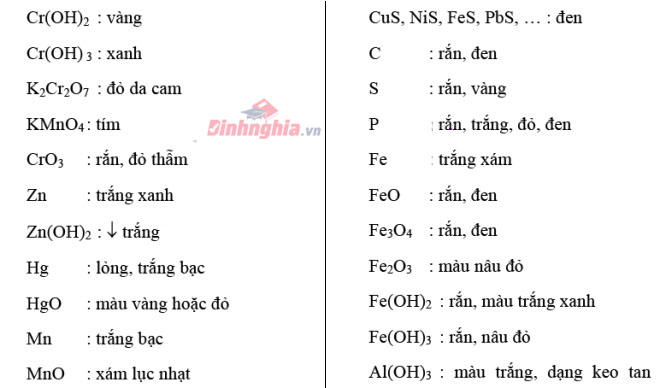

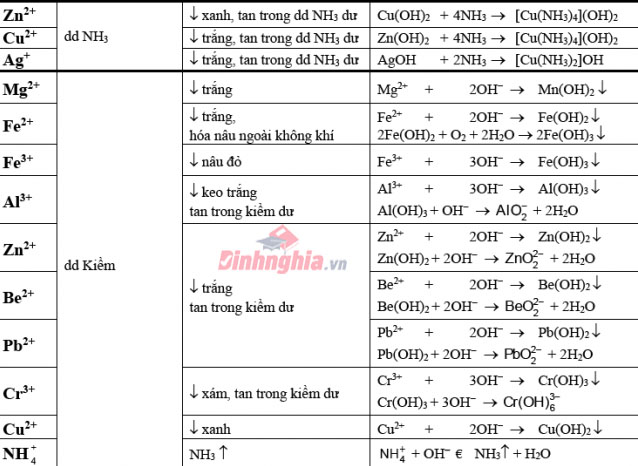
Bảng nhấn biết một trong những cation thường gặp
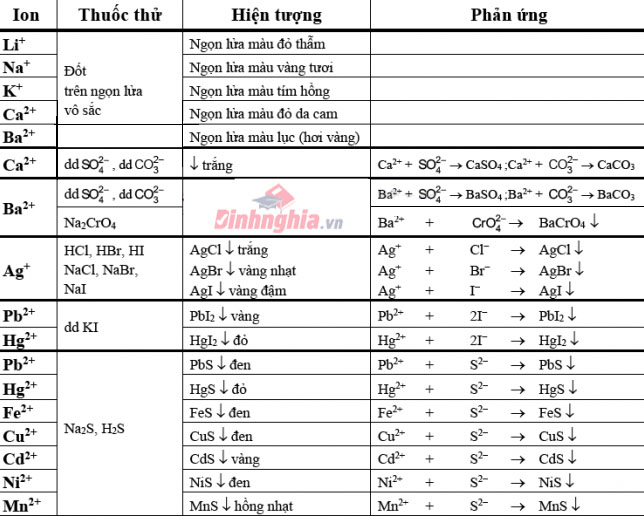
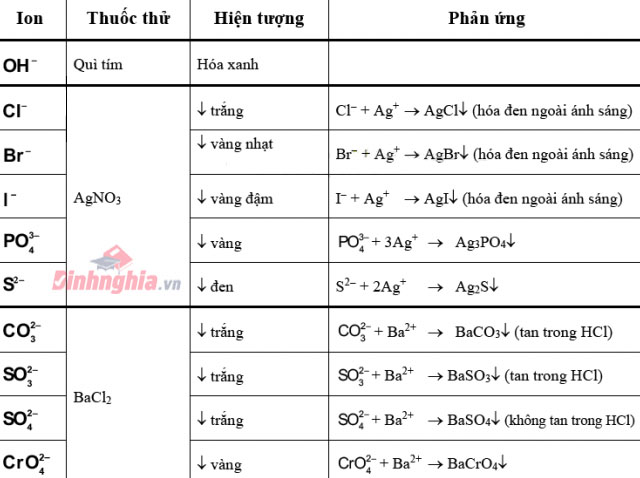
Bảng dấn biết một số trong những anion xuất xắc gặp
Như vậy, DINHNGHIA.VN đã giúp đỡ bạn tổng hòa hợp những kỹ năng và kiến thức hữu ích về nhà đề phương thức nhận biết những chất hóa học. Chúc bạn luôn học tốt!.
Lớp 1Tài liệu Giáo viên
Lớp 2Lớp 2 - liên kết tri thức
Lớp 2 - Chân trời sáng sủa tạo
Lớp 2 - Cánh diều
Tài liệu Giáo viên
Lớp 3Lớp 3 - liên kết tri thức
Lớp 3 - Chân trời sáng sủa tạo
Lớp 3 - Cánh diều
Tài liệu Giáo viên
Lớp 4Sách giáo khoa
Sách/Vở bài xích tập
Tài liệu Giáo viên
Lớp 5Sách giáo khoa
Sách/Vở bài xích tập
Tài liệu Giáo viên
Lớp 6Lớp 6 - kết nối tri thức
Lớp 6 - Chân trời sáng tạo
Lớp 6 - Cánh diều
Sách/Vở bài tập
Tài liệu Giáo viên
Lớp 7Lớp 7 - kết nối tri thức
Lớp 7 - Chân trời sáng sủa tạo
Lớp 7 - Cánh diều
Sách/Vở bài tập
Tài liệu Giáo viên
Lớp 8Sách giáo khoa
Sách/Vở bài tập
Tài liệu Giáo viên
Lớp 9Sách giáo khoa
Sách/Vở bài bác tập
Tài liệu Giáo viên
Lớp 10Lớp 10 - liên kết tri thức
Lớp 10 - Chân trời sáng sủa tạo
Lớp 10 - Cánh diều
Sách/Vở bài tập
Tài liệu Giáo viên
Lớp 11Sách giáo khoa
Sách/Vở bài tập
Tài liệu Giáo viên
Lớp 12Sách giáo khoa
Sách/Vở bài bác tập
Tài liệu Giáo viên
giáo viênLớp 1
Lớp 2
Lớp 3
Lớp 4
Lớp 5
Lớp 6
Lớp 7
Lớp 8
Lớp 9
Lớp 10
Lớp 11
Lớp 12

Các dạng bài bác tập hóa học lớp 9Chương 1: các loại hợp hóa học vô cơ
Chương 2: Kim loại
Chương 3: Phi kim. Qua quýt về bảng tuần hoàn các nguyên tố hóa học
Chương 4: Hiđrocacbon. Nhiên liệu
Chương 5: Dẫn xuất của Hiđrocacbon. Polime
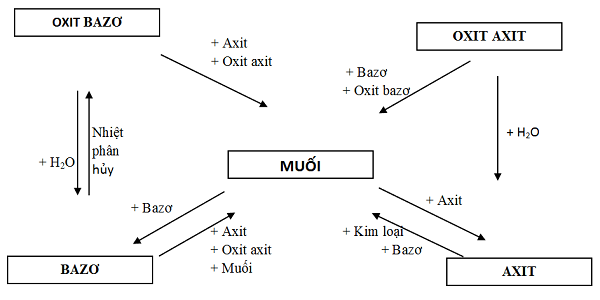
Phương pháp nhận biết các hóa học vô khốn cùng hay, chi tiết
Trang trước
Trang sau
Lý thuyết và phương pháp giải
Dựa vào tính chất hoá học tập và các dấu hiệu phân biệt các hợp hóa học vô cơ (kết tủa, khí, thay đổi màu sắc dung dịch…) đã có học nhằm tiến hành nhận biết các hợp chất vô cơ.
Phương pháp giải bài tập:
- cách 1: Trích chủng loại thử (có thể đánh số các ống nghiệm nhằm tiện theo dõi).
- cách 2: chọn thuốc test để phân biệt (tuỳ theo yêu ước của đề bài: thuốc thử tuỳ chọn, hạn chế hay là không dùng thuốc thử như thế nào khác).
- cách 3: mang đến thuốc demo vào mẫu, trình bày hiện tượng quan lại sát, đúc kết kết luận đã nhận ra hoá chất nào.
- cách 4: Viết phương trình làm phản ứng minh hoạ.
Các dạng bài bác tập cơ bản
1. Dạng bài bác tập nhận ra bằng thuốc thử tự chọn.
a) nhận biết chất rắn:
- nếu như đề yêu thương cầu nhận ra các chất ở thể rắn, hãy thử phân biệt theo thứ tự:
+ cách 1: thử tính tan trong nước.
+ bước 2: Thử bởi dung dịch axit (HCl, H2SO4, HNO3…).
+ cách 3: Thử bởi dung dịch kiềm.
- rất có thể thêm lửa hoặc nhiệt độ, nếu cần.
b) nhận ra dung dịch.
- nếu phải nhận biết các dung dịch mà trong đó có axit hoặc bazơ cùng muối thì cần dùng quì tím (hoặc dung dịch phenolphtalein) để nhận biết axit hoặc bazơ trước rồi mới phân biệt đến muối hạt sau.
- nếu phải phân biệt các muối tan, thường xuyên nên nhận thấy anion (gốc axit) trước, nếu không được mới nhận biết cation (kim nhiều loại hoặc amoni) sau.
c) nhận biết chất khí.
- Khi nhận ra một hóa học khí bất kì, ta dẫn khí đó lội qua dung dịch, hoặc sục khí đó vào dung dịch, hoặc dẫn khí kia qua hóa học rắn rồi nung…Không làm ngược lại.
2. Dạng bài bác tập nhận thấy với thuốc demo hạn chế.
- ví như đề yêu cầu chỉ cần sử dụng một thuốc thử: thuở đầu nên dùng dung dịch axit hoặc hỗn hợp bazơ. Còn nếu không được hãy dùng thuốc demo khác.
- trường hợp đề yêu ước chỉ cần sử dụng quỳ tím thì lưu ý những hỗn hợp muối làm đổi màu quì tím.
3. Dạng bài bác tập không được sử dụng thuốc thử bên ngoài.
- trường hợp đề yêu ước không được dùng thuốc thử mặt ngoài, nên làm theo thứ tự giải pháp bước sau:
+ cách 1: đến từng chất chức năng với nhau.
VD: đưa sử nhận ra n dung dịch hoá chất đựng vào n lọ riêng rẽ biệt. Thực hiện thí nghiệm theo trình tự:
- Ghi số lắp thêm tự 1, 2, 3…, n lên n lọ đựng n hỗn hợp hoá chất bắt buộc nhận biết.
- Trích mẫu mã thử n hỗn hợp vào n ống thử được khắc số tương ứng.
+ cách 2: Sau n thí nghiệm đến khi hoàn tất phải tạo bảng tổng kết hiện nay tượng.
+ cách 3: dựa vào bảng tổng kết hiện tượng lạ để rút ra dìm xét, kết luận đã nhận được hoá hóa học nào (có kèm theo các phương trình phản nghịch ứng minh hoạ)
Bài tập vận dụng
Bài 1: Bằng phương thức hoá học tập hãy nhận ra các chất riêng biệt sau:
a) Ba
O, Mg
O, Cu
O
b) HCl, Na
OH, Na2SO4, Na
Cl
c) CO, CO2, SO2
Hướng dẫn:
- Trích những mẫu test vào những ống nghiệm lẻ tẻ đã đặt số theo sản phẩm tự để dìm biết.
a) Hoà tung 3 oxit kim loại bằng nước → nhận thấy được Ba
O tan tạo nên dung dịch trong suốt: Ba
O + H2O → Ba(OH)2
Hai oxit còn sót lại cho công dụng với hỗn hợp HCl, phân biệt Mg
O tạo thành dung dịch không màu, Cu
O tan tạo thành dung dịch màu sắc xanh.
Mg
O + 2HCl → Mg
Cl2 + H2O
Cu
O + 2HCl → Cu
Cl2 + H2O
b) dùng quỳ tím → nhận thấy HCl do làm quỳ tím hoá đỏ, Na
OH làm quỳ tím hoá xanh, Na2SO4 cùng Na
Cl ko làm chuyển màu quỳ tím.
Dùng dung dịch Ba
Cl2 để nhận ra 2 dung dịch không làm thay đổi màu sắc quỳ tím → Na2SO4 bội nghịch ứng sản xuất kết tủa trắng, Na
Cl không phản ứng.
Ba
Cl2 + Na2SO4 → Ba
SO4 (kết tủa trắng) + 2Na
Cl
c) Dẫn từng khí qua dung dịch nước brom nhận biết SO2 làm mất đi màu nước brom.
SO2 + Br2 + 2H2O → 2HBr + H2SO4
Hai khí còn sót lại dẫn qua dung dịch nước vôi trong → phân biệt CO2 có tác dụng đục nước vôi trong, teo không bội nghịch ứng.
CO2 + Ca(OH)2 → Ca
CO3↓ + H2O
Bài 2: Chỉ được dùng nước, hãy nhận biết các hóa học rắn sau: Na
OH, Al2O3, Ba
CO3, Ca
O.
Hướng dẫn:
Hoà tan những mẫu test vào nước nhận biết Ca
O tan chế tạo ra dung dịch đục, Na
OH tạo ra dung dịch vào suốt, còn Al2O3 và Ba
CO3 không tan.
Lấy dung dịch Na
OH vừa nhận thấy ở trên bỏ vô 2 mẫu mã thử không biến thành hoà tung trong nước → Al2O3 tan, Ba
CO3 không tan.
Ca
O + H2O → Ca(OH)2
2Na
OH + Al2O3 → 2Na
Al
O2 + H2O
Bài 3: Không được sử dụng thêm dung dịch thử làm sao khác, hãy nhận thấy các hỗn hợp sau bằng cách thức hoá học: Na2CO3, HCl, Ba
Cl2
Hướng dẫn:
- Trích chủng loại thử của từng hỗn hợp vào các ống nghiệm và đánh số sản phẩm tự tương ứng.
- Lần lượt cho 1 mẫu thử tính năng với hai mẫu thử còn lại. Sau 6 lượt thí nghiệm, ta có hiệu quả như bảng sau:
| Na2CO3 | HCl | Ba Cl2 | |
| Na2CO3 | ↑ | ↓ trắng | |
| HCl | ↑ | Không phản bội ứng | |
| Ba Cl2 | ↓ trắng | Không phản nghịch ứng |
Dựa vào bảng trên, ta thấy sinh hoạt lượt thể nghiệm nào sinh sản khí và có kết tủa white thì chất bé dại vào là Na2CO3, mẫu thử nào tạo ra khí là HCl, mẫu thử chế tạo kết tủa trắng là Ba
Cl2.
Na2CO3 + 2HCl → 2Na
Cl + H2O + CO2↑
Ba
Cl2 + Na2CO3 → Ba
CO3 + 2Na
Cl
ĐỀ THI, GIÁO ÁN, GIA SƯ DÀNH mang đến GIÁO VIÊN VÀ PHỤ HUYNH LỚP 9
Bộ giáo án, bài bác giảng powerpoint, đề thi giành riêng cho giáo viên cùng gia sư giành riêng cho phụ huynh tại https://tailieugiaovien.com.vn/ . Cung cấp zalo Viet
Jack Official









